Агрегатное
состояние вещества
В этой работе показана причина существования вещества в нескольких агрегатных состояниях.
Дискретное строение вещества известно очень давно. Также очень давно известно,
что свойства веществ определяются взаимодействием его молекул, но это древнее знание не
используется в современной физике для определения агрегатного состояния вещества. Для
определения агрегатного состояния вещества чаще всего используют или перечисление его
внешних признаков вещества в различных агрегатных состояниях, или расплывчатые критерии, по которым нельзя определить, в каком агрегатном состоянии находится вещество. Максимум, что можно найти в учебниках по физике - это
голословные, весьма размытые декларации типа «Существование у вещества нескольких агрегатных
состояний обусловлено различиями в тепловом движении его молекул (атомов) и в
их взаимодействии». При этом, вывести точные критерии агрегатного состояния вещества не очень сложно. Начнём с определений.
«Агрегатные состояния вещества, состояния
одного и того же вещества (например, воды, железа, серы), переходы между
которыми сопровождаются скачкообразным изменением ряда физических свойств
(плотности, энтропии и др.). Обычно рассматривают газообразное,
жидкое и твёрдое агрегатные состояния (иногда ещё и плазменное). Существование
у вещества нескольких агрегатных состояний обусловлено различиями в тепловом
движении его молекул (атомов) и в их взаимодействии». [2]
Ни в одном физическом определении не раскрыто, какое
именно взаимодействие молекул определяет агрегатные состояния вещества. Сейчас
для определения агрегатных состояний вещества
используют приблизительные критерии, созданные исключительно для того,
чтобы студенты задавали меньше вопросов, поскольку однозначно определить
агрегатное состояние вещества по этим критериям невозможно.
«Элементарная работа ![]() силы
силы ![]() при увеличении
расстояния между молекулами на
при увеличении
расстояния между молекулами на ![]() совершается за счет
уменьшения взаимной потенциальной энергии молекул, т.е.
совершается за счет
уменьшения взаимной потенциальной энергии молекул, т.е.
![]() (1)
(1)
Из анализа качественной зависимости
потенциальной энергии взаимодействия молекул от расстояния между ними, (рис. 1)
следует, что если молекулы находятся друг от друга на расстоянии, на котором
межмолекулярные силы взаимодействия не действуют, (![]() ), то
), то ![]() . При постепенном сближении молекул между ними появляются
силы притяжения (
. При постепенном сближении молекул между ними появляются
силы притяжения (![]() ), которые совершают положительную работу (
), которые совершают положительную работу (![]() ).
).
Тогда, согласно (1), потенциальная
энергия взаимодействия уменьшается, достигая минимума при
![]() . При
. При ![]() с уменьшением
с уменьшением ![]() силы отталкивания (
силы отталкивания (![]() ) резко возрастают и совершаемая работа против них
отрицательна (
) резко возрастают и совершаемая работа против них
отрицательна (![]() ).
).
Потенциальная энергия начинает тоже резко
возрастать и становится положительной. Из данной потенциальной кривой следует,
что система из двух взаимодействующих
молекул в состоянии устойчивого равновесия (![]() ) обладает минимальной потенциальной энергией.
) обладает минимальной потенциальной энергией.
Критерием различных агрегатных состояний
вещества является соотношение между
величинами ![]() и
и ![]() .
. ![]() - наименьшая
потенциальная энергия взаимодействия молекул определяет работу, которую нужно
совершить против сил притяжения для того, чтобы разъединить молекулы,
находящиеся в равновесии (
- наименьшая
потенциальная энергия взаимодействия молекул определяет работу, которую нужно
совершить против сил притяжения для того, чтобы разъединить молекулы,
находящиеся в равновесии (![]() );
); ![]() определяет
удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического
(теплового) движения молекул.
определяет
удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического
(теплового) движения молекул.
Если ![]() , то вещество находится в газообразном состоянии, так как
интенсивное тепловое движение молекул препятствует соединению молекул,
сблизившихся до расстояния
, то вещество находится в газообразном состоянии, так как
интенсивное тепловое движение молекул препятствует соединению молекул,
сблизившихся до расстояния ![]() , т.е. вероятность образования агрегатов из молекул
достаточно мала. Если
, т.е. вероятность образования агрегатов из молекул
достаточно мала. Если ![]() , то вещество находится в твердом агрегатном состоянии, так как
молекулы, притягиваясь друг к другу, не могут
удалиться на значительные расстояния и колеблются около положений равновесия,
определяемого расстоянием
, то вещество находится в твердом агрегатном состоянии, так как
молекулы, притягиваясь друг к другу, не могут
удалиться на значительные расстояния и колеблются около положений равновесия,
определяемого расстоянием ![]() . Если
. Если ![]() , то вещество находится в агрегатном состоянии жидкости, так как в
результате теплового движения молекулы перемещаются в пространстве, обмениваясь
местами, но не расходясь на расстояние, превышающее
, то вещество находится в агрегатном состоянии жидкости, так как в
результате теплового движения молекулы перемещаются в пространстве, обмениваясь
местами, но не расходясь на расстояние, превышающее ![]() .
.
Таким образом, любое вещество в
зависимости от температуры может находиться в газообразном, жидком или твердом
агрегатном состоянии, причём температура перехода из одного агрегатного
состояния в другое зависит от значения ![]() для данного вещества.
Например, у инертных газов
для данного вещества.
Например, у инертных газов ![]() мало, а у металлов
велико, поэтому при обычных (комнатных) температурах они находятся
соответственно в газообразном и твердом состояниях». [1]
мало, а у металлов
велико, поэтому при обычных (комнатных) температурах они находятся
соответственно в газообразном и твердом состояниях». [1]
Привязка агрегатного состояния вещества
только к температуре, без учёта других факторов, физически не корректна.
Агрегатное состояние вещества зависит также и от концентрации молекул, и от
давления. Например, вода, в зависимости от давления, может находиться в жидком
или газообразном состоянии в диапазоне температур от ![]() до
до ![]() .
.
Агрегатное состояние вещества определяют
силы межмолекулярного взаимодействия
Ещё в четвёртом веке до
н.э. было известно о дискретном строении вещества, о том, что свойства вещества определяются свойствами его
атомов (молекул). Прошло двадцать четыре
века, но знание о дискретном строении вещества до сих пор не используется для вывода критерия,
определяющего агрегатное состояние вещества.
Сейчас в молекулярной физике известно, что главной
причиной, определяющей существование вещества в каком
либо определённом агрегатном состоянии, является величина сил взаимного отталкивания и
притяжения. Однако эти знания не востребованы для формулировки
физического определения агрегатного состояния вещества.
«В ХХ веке, по мере развития
представлений о строении атома и квантовой механики, было выяснено, что между
молекулами вещества одновременно действуют силы притяжения и силы отталкивания.
На рис. 1,а приведена качественная зависимость сил межмолекулярного
взаимодействия от расстояния ![]() между молекулами, где
между молекулами, где ![]() и
и ![]() соответственно силы
отталкивания и притяжения,
соответственно силы
отталкивания и притяжения, ![]() - их результирующая.
Силы отталкивания считаются положительными, а силы взаимного притяжения -
отрицательными.
- их результирующая.
Силы отталкивания считаются положительными, а силы взаимного притяжения -
отрицательными.
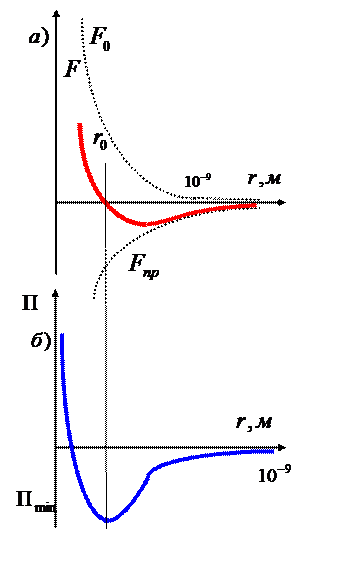
Рис. 1
На расстоянии ![]() результирующая сила
результирующая сила ![]() , т.е. силы притяжения и отталкивания уравновешивают друг
друга. Таким образом, расстояние
, т.е. силы притяжения и отталкивания уравновешивают друг
друга. Таким образом, расстояние ![]() соответствует
равновесному расстоянию между молекулами, на котором бы они находились в
отсутствии теплового движения. При
соответствует
равновесному расстоянию между молекулами, на котором бы они находились в
отсутствии теплового движения. При ![]() преобладают силы отталкивания (
преобладают силы отталкивания (![]() ), при
), при ![]() - силы притяжения(
- силы притяжения(![]() ).
).
На расстояниях ![]() м. межмолекулярные
силы практически отсутствуют (
м. межмолекулярные
силы практически отсутствуют (![]() )». [1]
)». [1]
Зависимость силы взаимодействия молекул ![]() от расстояния
между ними
от расстояния
между ними ![]() является очень важным
физическим фактором. Эта зависимость позволяет предсказать переход вещества из
одного агрегатного состояния в другое, например, испарение и конденсацию. Эта
зависимость также позволяет предсказать поведение вещества при внешней
нагрузке (давлении). При изменении расстояния между молекулами возникает сила
является очень важным
физическим фактором. Эта зависимость позволяет предсказать переход вещества из
одного агрегатного состояния в другое, например, испарение и конденсацию. Эта
зависимость также позволяет предсказать поведение вещества при внешней
нагрузке (давлении). При изменении расстояния между молекулами возникает сила ![]() , с которой вещество сопротивляется внешней нагрузке.
, с которой вещество сопротивляется внешней нагрузке.
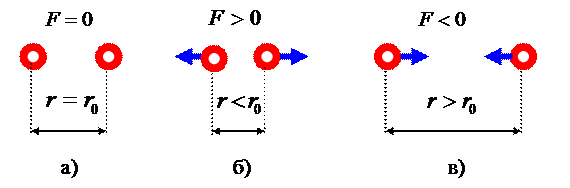
Рис. 2
При равновесном расстоянии между
молекулами ![]() не возникает сил
притяжения и отталкивания (рис.2,а).
не возникает сил
притяжения и отталкивания (рис.2,а).
При уменьшении расстояния между
молекулами ![]() (при внешней нагрузке
сжатия), возникают силы отталкивания
(при внешней нагрузке
сжатия), возникают силы отталкивания ![]() (рис.2,б). Они
направлены так, чтобы расстояние между молекулами снова стало
(рис.2,б). Они
направлены так, чтобы расстояние между молекулами снова стало ![]() .
.
При увеличении расстояния между
молекулами ![]() (при внешней нагрузке
растяжения), возникают силы притяжения
(при внешней нагрузке
растяжения), возникают силы притяжения ![]() (рис.2,в). Они
направлены так, чтобы расстояние между молекулами снова стало
(рис.2,в). Они
направлены так, чтобы расстояние между молекулами снова стало ![]() . Таким образом, молекулы вещества противостоят разрушению. В
этом причина устойчивости твёрдого состояния вещества.
. Таким образом, молекулы вещества противостоят разрушению. В
этом причина устойчивости твёрдого состояния вещества.
Универсальный график агрегатных состояний
вещества
Агрегатные
состояния вещества удобнее всего показывать на одном графике. Графики изменения
потенциальной энергии молекул в
зависимости от расстояния между ними у различных веществ имеют индивидуальные
характеристики, но одну форму. Этот график позволяет понять причину существования вещества в определённых агрегатных состояниях и причину фазовых переходов, например, испарение и конденсацию. Индивидуальные характеристики различных веществ
можно учесть введением коэффициентов. При этом нужно помнить, что есть закон Максвелла о распределнит энергий теплового движения молекул. В связи с этим, например, в твердом состоянии вещества есть молекулы, обладающие свойствами жидкости, и есть молекулы, обладающие свойствами газа. С такими молекулами твёрдое тело приобретает свойства пластичности и возможности испарения молекул с поверхности твёрдого тела и конденсацию на поверхность твёрдого тела. В агрегатном сотоянии жидкости есть молекулы, обладающие свойствами твёрдого тела и газа. Однако эти молекулы, в связи с их небольшим количеством не могут повлиять на принцип самоорганизации большинства молекул в определённое агрегатное состояние вещества. Влияние таких молекул на свойства вещества в целом может быть значительным только в температурном диапазоне, близком к фазовым переходам.
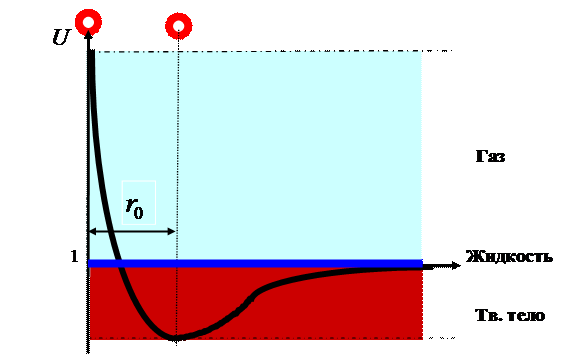
Рис. 3. Универсальный график агрегатных
состояний вещества без внешнего давления.
На (рис.3) показаны зоны твёрдого, жидкого и
газообразного агрегатного состояния для любых веществ. На универсальном графике хорошо
видно, почему вещество существует в определённых агрегатных состояниях. На
основании универсального графика можно показать точные физические признаки
агрегатных состояний вещества.
Универсальный график агрегатных состояний вещества
составлен для условий отсутствия внешнего давления. Внешнее давление изменяет
свойства вещества. Влияние внешнего воздействия на свойства молекул вещества
должно рассматриваться в разделе молекулярных основ сопротивления материалов,
но современной физике такого раздела нет. Если будет интерес читателей, эта
работа будет опубликована позднее.
То, что универсальный график существует, прикладная
наука давно заметила, и использует, например, для сравнительного анализа
металлов. Чтобы сравнивать свойства различных металлов между собой, испытания
проводят при так называемых сходственных
температурах, составляющих одинаковую долю от абсолютной температуры
плавления, например, 0,5 от абсолютной температуры плавления. Для свинца это ![]() С, для железа
С, для железа ![]() С. При этих
температурах свойства свинца и железа достаточно близки.
С. При этих
температурах свойства свинца и железа достаточно близки.
Далее рассмотрим по порядку агрегатные состояния
вещества: твёрдое тело, жидкость и газ.
Агрегатное состояние вещества –
твёрдое тело
Основные положения атомистики были
сформулированы в четвёртом веке до н.э., но за это время молекулярная физика оказалась способна вывести
только приблизительные описание агрегатных состояний вещества, пользуясь которыми,
в большинстве случаев определить агрегатное состояние вещества невозможно.
Сейчас физическое определение твёрдого
тела имеет приблизительный характер. В нём не раскрывается причина самоорганизации
молекул вещества именно таким образом, а ведь это основная задача молекулярной
физики.
«Твёрдое тело - характеризуется
стабильностью формы и тем, что образующие его атомы совершают малые (тепловые)
колебания вокруг фиксированных положений равновесия. Твердые тела делятся на кристаллические и аморфные. В кристаллах существует
дальний порядок в расположении атомов и молекул, в аморфных же телах колебания
частиц происходят вокруг хаотически расположенных точек.
Различают твердые тела с ионной,
ковалентной, металлической и другими типами связей, что обусловливает
разнообразие их физических свойств. Так, вещества с ионной связью хрупки, в то
время как типичные металлы очень пластичны. Электрические, магнитные и
некоторые тепловые свойства твердых тел в основном определяются характером
движения валентных электронов его атомов, который обусловлен типом связи. По
электрическим свойствам твердые тела делятся на диэлектрики, полупроводники и
металлы; по магнитным - на диамагнетики, парамагнетики, и тела с упорядоченной
магнитной структурой». [2]
Для физического определения используется перечисление
макроскопических свойств вещества. Причина, по которой молекулы вещества
принимают качества твёрдого тела, не указана. Максимум, на что оказалась
способна молекулярная физика – это вывести приблизительные критерии агрегатных
состояний вещества. Настолько приблизительный, что под критерий
твёрдого агрегатного состояния одновременно попадают вещества в твёрдом и
жидком агрегатном состоянии.
«Если ![]() , то вещество находится в твердом состоянии, так как
молекулы, притягиваясь друг к другу, не могут
удалиться на значительные расстояния и колеблется около положений равновесия,
определяемого расстоянием
, то вещество находится в твердом состоянии, так как
молекулы, притягиваясь друг к другу, не могут
удалиться на значительные расстояния и колеблется около положений равновесия,
определяемого расстоянием ![]() ». [1]
». [1]
В этом критерии нет чёткой границы
агрегатного состояния вещества - насколько
![]() должна быть больше
должна быть больше ![]() , и что произойдёт,
если
, и что произойдёт,
если ![]() . Это удивительно, поскольку в молекулярной физике уже давно
точно определить, с чем связано именно
твёрдое состояние вещества.
. Это удивительно, поскольку в молекулярной физике уже давно
точно определить, с чем связано именно
твёрдое состояние вещества.
Для точного определения
твёрдого агрегатного состояния вещества рассмотрим график взаимодействия двух
молекул вещества (рис. 4). При этом одна
молекула находится в начале координат, другая на расстоянии ![]() .
.
Молекулы вещества в
твёрдом состоянии совершают колебания вокруг положения равновесия внутри
потенциальной ямы на расстояние ![]() за счет кинетической
энергии. Осцилляция молекул вокруг центра равновесия
за счет кинетической
энергии. Осцилляция молекул вокруг центра равновесия ![]() ограничиваются
потенциальной кривой. Нахождение молекул вещества в потенциальной яме является
отличительным признаком твёрдого состояния вещества.
ограничиваются
потенциальной кривой. Нахождение молекул вещества в потенциальной яме является
отличительным признаком твёрдого состояния вещества.
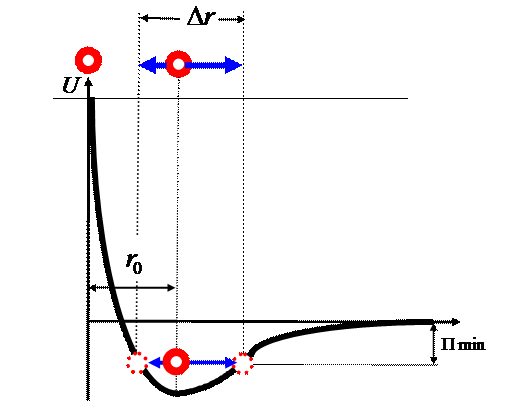
Рис. 4. Взаимодействие двух молекул вещества в
твёрдом агрегатном состоянии.
На графике ![]() - наименьшая
потенциальная энергия разрыва связи двух молекул. Величина
- наименьшая
потенциальная энергия разрыва связи двух молекул. Величина ![]() определяет работу, которую нужно совершить против сил
притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии (
определяет работу, которую нужно совершить против сил
притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии (![]() ).
).
При внешней нагрузке на
твёрдое тело, может изменяться расстояние ![]() между молекулами вещества, Это может быть
причиной выхода молекул за пределы потенциальной ямы. В этом случае твёрдое
тело разрушается.
между молекулами вещества, Это может быть
причиной выхода молекул за пределы потенциальной ямы. В этом случае твёрдое
тело разрушается.
Вторая причина
разрушения твёрдого тела температура. При увеличении температуры увеличивается
кинетическая энергия молекул, увеличивается осцилляция молекул ![]() ,
уменьшается
,
уменьшается ![]() (расстояние до краёв потенциальной ямы). Это
означает уменьшение прочности твёрдого тела. При этом надо помнить, что, в соответствии с Максвелловским распределением энергии молекул вещества, у части молекул будет энергия, соотвествующая агрегатному состоянию жидкости. С этими молекулами связаны пластичные свойства вещества. Также у части молекул будет энергия, соотвествующая агрегатному состоянию газа. С этими молекулами твёрдое тело приобретает некоторые свойства агрегатного состояния газа - например испарерие отдельных молекул с поверхности твёрдого тела.
(расстояние до краёв потенциальной ямы). Это
означает уменьшение прочности твёрдого тела. При этом надо помнить, что, в соответствии с Максвелловским распределением энергии молекул вещества, у части молекул будет энергия, соотвествующая агрегатному состоянию жидкости. С этими молекулами связаны пластичные свойства вещества. Также у части молекул будет энергия, соотвествующая агрегатному состоянию газа. С этими молекулами твёрдое тело приобретает некоторые свойства агрегатного состояния газа - например испарерие отдельных молекул с поверхности твёрдого тела.
Наличие у молекул
вещества ![]() , отличного от нуля, является отличительным признаком именно
твёрдого агрегатного состояния вещества. Это позволяет вывести физически корректное определение твёрдого
состояния вещества.
, отличного от нуля, является отличительным признаком именно
твёрдого агрегатного состояния вещества. Это позволяет вывести физически корректное определение твёрдого
состояния вещества.
«Твердое агрегатное
состояние вещества - это такое состояние, при котором его атомы (молекулы,
ионы) находятся в «потенциальной яме» и не могут ее покинуть».
Агрегатное состояние вещества –
жидкость
Физическое определение жидкости, также как и
физическое определение твёрдого тела, имеет приблизительный
характер. В нём не раскрывается причина
самоорганизации молекул вещества в это
агрегатное состояние.
«Жидкость - агрегатное состояние вещества, сочетающее
в себе черты твердого состояния (сохранение объема, определенная прочность на
разрыв) и газообразного (изменчивость формы). Для жидкости характерны ближний
порядок в расположении частиц (молекул, атомов) и малое различие в кинетической
энергии теплового движения молекул и их потенциальной энергии взаимодействия.
Тепловое движение молекул жидкости состоит из колебаний около положений равновесия и сравнительно редких перескоков
из одного равновесного состояния в другое, с этим и связана текучесть
жидкости».[2]
Сейчас в молекулярной физике есть очень приблизительный критерий,
который не позволяет точно определить, в каком именно агрегатном состоянии
находятся молекулы вещества. Используя критерий для жидкости, невозможно отличить жидкость от газа или твёрдого тела. Это явная недоработка теоретической физики.
«Если ![]() , то вещество находится в жидком состоянии, так как в
результате теплового движения молекулы перемещаются в пространстве, обмениваясь
местами, но не расходясь на расстояние, превышающее
, то вещество находится в жидком состоянии, так как в
результате теплового движения молекулы перемещаются в пространстве, обмениваясь
местами, но не расходясь на расстояние, превышающее ![]() ».[1]
».[1]
В этом определении указывается следствие, что молекулы
не привязаны к кристаллической решётке, но не указана причина, (хотя известна)
- то, что молекулы находятся на границе потенциальной ямы. Привязка критерия
агрегатного состояния только к температуре (![]() ) не даёт возможности однозначно определить агрегатное
состояние жидкости. Существующий критерий не учитывает давления над жидкостью,
и концентрации молекул, а это очень важные факторы. Для воды, например,
температура фазового перехода жидкость - пар при давлении
) не даёт возможности однозначно определить агрегатное
состояние жидкости. Существующий критерий не учитывает давления над жидкостью,
и концентрации молекул, а это очень важные факторы. Для воды, например,
температура фазового перехода жидкость - пар при давлении ![]() равняется
равняется ![]() , а при давлении
, а при давлении ![]() -
- ![]() . Любой критерий, привязанный к температуре, в этом диапазоне является не точным и не даёт ответа на вопрос, для ответа на который он был выведен –
в каком агрегатном состоянии находится вода. Такие же проблемы существуют и для
всех остальных веществ. Определить агрегатное состояние вещества очень просто. Для этого нужно
воспользоваться универсальным графиком агрегатных состояний вещества.
. Любой критерий, привязанный к температуре, в этом диапазоне является не точным и не даёт ответа на вопрос, для ответа на который он был выведен –
в каком агрегатном состоянии находится вода. Такие же проблемы существуют и для
всех остальных веществ. Определить агрегатное состояние вещества очень просто. Для этого нужно
воспользоваться универсальным графиком агрегатных состояний вещества.
Составим этот график взаимодействия двух молекул для
одного агрегатного состояния вещества - жидкости и объясним, исходя из этого
графика, причину самоорганизации молекул именно таким образом.
Из этого графика легко понять, что
происходит с веществом при его переходе из твёрдого агрегатного состояния в
жидкость.
При увеличении температуры твёрдого тела увеличивается
кинетическая энергия молекул, увеличивается величина осцилляций молекул ![]() вокруг положения
равновесия. Одновременно с этим уменьшается
вокруг положения
равновесия. Одновременно с этим уменьшается ![]() (расстояние до краёв
потенциальной ямы). При уменьшении
(расстояние до краёв
потенциальной ямы). При уменьшении ![]() до нуля, вещество
переходит в состояние жидкости.
до нуля, вещество
переходит в состояние жидкости.
На
графике видно, что агрегатное состояние жидкости соответствует выходу молекул
из потенциальной ямы. Это агрегатное состояние вещества в вакууме имеет очень
маленький температурный диапазон. При увеличении давления температурный
диапазон этого агрегатного состояния увеличивается за счёт конденсации молекул
из пара.
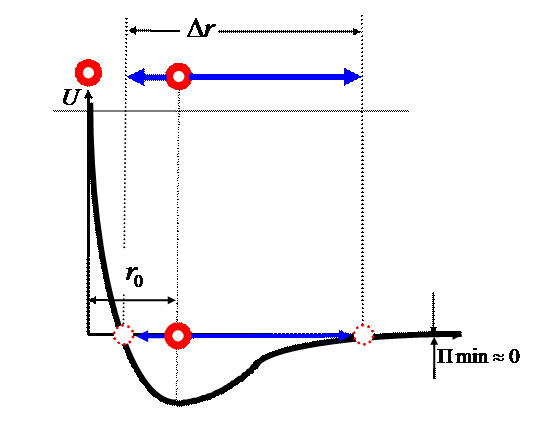
Рис. 5 Взаимодействие двух молекул вещества в
агрегатном состоянии жидкости.
Рассматривая левую часть графика видно,
что левая часть потенциальной ямы круче, чем у твёрдого тела, из чего следует
макроскопический вывод о практической несжимаемости жидкости.
Рассматривая правую часть графика, видно,
что выход из потенциальной ямы очень пологий, что говорит о незначительном
сопротивлении жидкости растяжению. Оно проявляется в виде поверхностного
натяжения.
Таким образом, мы можем вывести
физическое определение жидкости, имеющий чёткий критерий.
«Жидкость -
это такое состояние вещества, при котором все составляющие её
атомы (молекулы, ионы) находятся в «потенциальной
яме», но в своем колебательном движении имеют возможность её покидать».
Третье агрегатное состояние вещества - газ
Существующее физическое определение агрегатного
состояния газа является описательным, и не раскрывает причину существования
вещества в этом агрегатном состоянии.
«Газ - агрегатное состояние вещества, в
котором кинетическая энергия теплового движения его частиц (молекул, атомов,
ионов) значительно превосходит потенциальную энергию взаимодействий между
ними, в связи с
чем частицы движутся свободно, равномерно заполняя в отсутствие
внешних полей весь предоставленный им объем».[2]
В молекулярной физике есть приблизительный критерий, по
которому это агрегатное состояние нельзя однозначно определить.
«Если ![]() , то вещество находится в газообразном состоянии, так как
интенсивное тепловое движение молекул препятствует соединению молекул,
сблизившихся до расстояния
, то вещество находится в газообразном состоянии, так как
интенсивное тепловое движение молекул препятствует соединению молекул,
сблизившихся до расстояния ![]() , т.е. вероятность образования агрегатов из молекул
достаточно мала». [1]
, т.е. вероятность образования агрегатов из молекул
достаточно мала». [1]
Привязка критерия агрегатного состояния
газа только к температуре не даёт возможности однозначно определить это
агрегатное состояние, так как не учитываются другие важные физические факторы,
влияющие на агрегатное состояние - давление и концентрация молекул. Например, для
воды температура фазового перехода жидкость - пар при давлении ![]() равняется
равняется ![]() , а при давлении
, а при давлении ![]() -
- ![]() . Это означает, что в диапазоне температур от 0 до 374
градусов вода может находиться как в жидком, так и в газообразном состоянии, в
зависимости от давления. Любой критерий, привязанный к температуре, не сможет
однозначно ответить на основной вопрос, для которого он был выведен – в каком
агрегатном состоянии находится вода. Такие же проблемы существуют и для всех
остальных веществ.
. Это означает, что в диапазоне температур от 0 до 374
градусов вода может находиться как в жидком, так и в газообразном состоянии, в
зависимости от давления. Любой критерий, привязанный к температуре, не сможет
однозначно ответить на основной вопрос, для которого он был выведен – в каком
агрегатном состоянии находится вода. Такие же проблемы существуют и для всех
остальных веществ.
Агрегатное состояние
вещества - газ принципиально отличается от твёрдого и жидкого агрегатных
состояний вещества тем, что на графике изменения потенциальной энергий от
расстояния, атомы (молекулы) вещества в этом агрегатном состоянии не находятся
в потенциальной яме. В агрегатном состоянии газа свойства вещества определяются
только графиком потенциального барьера.
Поскольку в газе нет
равновесного положения молекул, в газе нельзя рассматривать взаимодействие двух
соседних молекул, совершающих регулярные осцилляции. В газе и паре необходимо
рассматривать взаимодействие как минимум трёх молекул, причём одна молекула
(№2) поочерёдно сталкивается с разными молекулами. При этом взаимодействие
молекул носит случайный характер, а движение – хаотично.
На (рис. 6) молекула
№2 движется от молекулы №1, с которой
уже произошло упругое столкновение, до молекулы №3, с которой столкновение
предстоит. Величина свободного пробега молекулы №2 составляет ![]() . После столкновения с
молекулой №3 молекула №2 будет двигаться к другой молекуле (№4) и т.д.
. После столкновения с
молекулой №3 молекула №2 будет двигаться к другой молекуле (№4) и т.д.
Из графика хорошо видно
макроскопическое свойство газа практически неограниченного расширения.
При рассмотрении графика (рис.6) видно, что потенциальный барьер достаточно
крутой, следовательно, газ может выдерживать значительное давление, но при этом
происходит уменьшение расстояния между молекулами.
На графике видно, что при уменьшении объема пара
меньше критического, возможно попадание молекул в потенциальную яму. Этот
физический феномен отличает состояние пара от состояния газа, в котором
вещество ни при каком давлении не переходит в состояние жидкости.
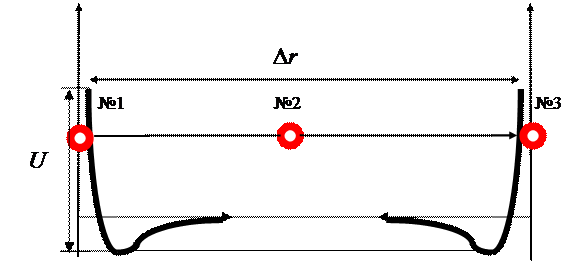
Рис. 6
Взаимодействие молекул в газообразном агрегатном состоянии вещества.
График на рисунке 6
позволяет понять физический принцип существования вещества в агрегатном
состоянии газа и вывести его физическое определение.
«Газ -
это такое состояние вещества, при котором его атомы (молекулы) не находятся в
потенциальной яме».
При этом следует помнить, что есть два различных
состояния газа – пар и газ. В паре есть силы отталкивания и силы сжатия. Силы
отталкивания в паре возникают от движения молекул, связанных с кинетической
энергией. Силы притяжения возникают от потенциальной энергии взаимодействия
молекул. Эти силы называются силами Ван – дер
– Ваальса. Наличие этих сил позволяет веществу при сжатии перейти из газообразного
состояния вещества в жидкость. Если при чтении возникают проблемы с открытием формул и рисунков, белые пятна молекулярной физики можно прочитать на http://sciteclibrary.ru/rus/catalog/pages/9456.html
ЛИТЕРАТУРА
1. Трофимова Т. И. Курс Физики. «Высшая школа». М.,1997.
2.Советский энциклопедический словарь.
М., «Советская энциклопедия.» 1985.
3. Чертов А.Г.
Физические величины. М., Высшая школа. 1990.
4. Дрюков В.М. Илюхина Н.И. Проектирование новых физических технологий.
Вопросы оборонной техники. Научно - технический сборник. № 1-2. М:, Н.Т.Ц. «Информтехника» 1995.
5.
Дрюков В.М. О чём молчат
физики. Тула. 2004.